1 şişe insan protrombin kompleksi içerir - nominal olarak: 280-760 IU insan kanı pıhtılaşma faktörü II, 180-480 IU insan kan pıhtılaşma faktörü VII, 500 IU insan kan pıhtılaşma faktörü IX, 360-600 IU insan kan pıhtılaşma faktörü X ve 260-620 IU proteinler C ve 240-640 IU protein S. İlacın spesifik aktivitesi, faktör IX aktivitesi olarak ifade edilen -0.6 IU / mg proteindir. Bu ilaç sodyum (75-125 mg / şişe) ve heparin (100-250 IU / şişe, 0.2-0.5 IU / IU faktör IX'a karşılık gelir) içerir.
| İsim | Paket içeriği | Aktif madde | Fiyat% 100 | Son düzenleme |
| Oktapleks | 1 şişe + seyreltici 20 ml, toz ve hazırlama için sulandırılmış çözüm şok için | Faktör II,
Faktör IX, Faktör x, Faktör VII, Protein C, Protein S | 2019-04-05 |
Aksiyon
Protein C ve protein S ile kombinasyon halinde protrombin kompleksi pıhtılaşma faktörlerinin (pıhtılaşma faktörleri II, VII, IX ve X) konsantrasyonu. Faktör VII, pıhtılaşmanın dışsal yolunu aktive eden aktif serin proteaz faktör VIIa'nın bir zimojenidir. Doku tromboplastin - faktör VIIa kompleksi, koagülasyon faktörleri IX ve X'i aktive ederek, IXa ve Xa faktörlerinin oluşumuyla sonuçlanır. Pıhtılaşma kademesinin daha fazla aktivasyonunun bir sonucu olarak, protrombin (faktör II) aktif formuna dönüştürülür ve trombine dönüştürülür. Trombinin etkisiyle fibrinojen, fibrine dönüştürülür ve bu da bir pıhtı oluşumuna yol açar. Diğer bileşenler, protein C ve protein S pıhtılaşma inhibitörleri de karaciğerde sentezlenir. Protein C'nin biyolojik aktivitesi, kofaktör protein S tarafından zorlanır. Aktive edilmiş protein C, faktör Va ve VIIIa'yı inaktive ederek pıhtılaşma sürecini inhibe eder. Protein C'nin bir kofaktörü olarak Protein S, pıhtılaşma inhibisyon sürecini destekler. İnsan protrombin kompleksinin uygulanması, K vitaminine bağlı pıhtılaşma faktörlerinin plazma konsantrasyonunda bir artışa neden olur ve bir veya daha fazla pıhtılaşma faktörünün eksikliği olan hastalarda pıhtılaşma bozukluklarını geçici olarak düzeltebilir. T0.5 aşağıdaki gibidir: faktör II 48-60 saat, faktör VII 1.5-6 saat, faktör IX 20-24 saat, faktör X 24-48 saat.
Dozaj
Damardan. İkame tedavisinin dozu ve süresi, hastalığın ciddiyetine, kanamanın yeri ve kapsamına ve hastanın klinik durumuna bağlıdır. Dozlama miktarı ve sıklığı her hasta için ayrı ayrı hesaplanmalıdır. Doz aralığı, protrombin kompleksinin bireysel koagülasyon faktörlerinin yarılanma ömrüne göre ayarlanmalıdır. Bireysel dozaj, yalnızca hastanın plazmasındaki pıhtılaşma faktörlerinin miktarının düzenli olarak belirlenmesi temelinde veya protrombin kompleksi düzeyini (protrombin zamanı, INR) belirlemek için kapsamlı testler ve hastanın klinik durumunun sürekli izlenmesi temelinde belirlenebilir. Büyük ameliyatlar durumunda, pıhtılaşma faktörlerini belirleyerek ikame tedavisinin dikkatli bir şekilde izlenmesi (spesifik pıhtılaşma faktörleri için testler ve / veya protrombin kompleksi seviyesini belirlemek için testler kullanılarak) gereklidir. K vitamini antagonistleri ile tedavi durumunda ameliyat sırasında kanama ve kanamanın profilaksisi Doz, tedavi öncesi INR'ye ve hedef INR'ye bağlıdır. Farklı başlangıç INR seviyeleri için INR'yi (1 saatte ≤1,2) normalleştirmek için gereken yaklaşık dozlar (ml / kg sulandırılmış preparat): INR 2-2,5 - yaklaşık doz 0,9-1,3 ml / kg canlı ağırlık; INR 2.5-3 - yaklaşık 1.3-1.6 ml / kg vücut ağırlığı dozu; INR 3-3,5 - yaklaşık doz 1,6-1,9 ml / kg canlı ağırlık; INR> 3,5 - yaklaşık doz> 1,9 ml / kg Tek bir doz 3000 IU'yu geçmemelidir. (120 ml preparat). K vitamini antagonistlerinin neden olduğu hemostaz bozukluklarının düzeltilmesi yaklaşık 6-8 saat sürer, ancak aynı anda uygulanan K vitamininin etkisi genellikle 4-6 saat içinde ortaya çıkar, bu nedenle K vitamini uygulandığında genellikle insan protrombin kompleksinin yeniden uygulanması gerekmez. deneysel verilere göre hesaplanır ve etkinin geri kazanımı ve süresi değişebilir, bu nedenle tedavi sırasında INR takibi zorunludur.Spesifik bir pıhtılaşma faktörü hazırlığı olmadığında, K vitamini bağımlı koagülasyon faktörleri II ve X'in doğuştan eksikliklerinde ameliyat sırasında kanama ve kanamanın profilaksisi. Gerekli doz deneysel verilerden hesaplanır ve yaklaşık 1 IU vücut ağırlığı kg başına faktör II veya X plazma faktör II veya X aktivitesini sırasıyla 0,02 ve 0,017 IU / ml artırır. Uygulanan spesifik bir pıhtılaşma faktörünün dozu, o faktör için WHO standardına uygun olan Uluslararası Birimler (IU) cinsinden ifade edilir. Plazmadaki spesifik bir pıhtılaşma faktörünün aktivitesi, yüzde (normal plazmaya göre) veya Uluslararası Birimlerde (belirli bir pıhtılaşma faktörü için uluslararası standarda göre) ifade edilir. Bir pıhtılaşma faktörü aktivitesinin bir Uluslararası Birimi (IU), 1 ml normal insan plazmasındaki miktara eşdeğerdir. Örneğin, gerekli faktör X dozunun hesaplanması, vücut ağırlığının kilogramı başına 1 Uluslararası Birim (IU) faktör X'in plazma faktörü X aktivitesini 0,017 IU / ml artırdığı deneysel verilere dayanmaktadır. Gerekli doz, aşağıdaki formül kullanılarak hesaplanır: Gerekli birimler = vücut ağırlığı (kg) x istenen faktör X artışı (IU / ml) x 59, burada 59 (ml / kg) varsayılan geri kazanım indeksidir. Faktör II için gerekli dozlar: Gerekli birimler = vücut ağırlığı (kg) x istenen faktör II artışı (IU / ml) x 50. Bireysel geri kazanım değerleri biliniyorsa, bunlar hesaplama için kullanılmalıdır. İnfüzyona 1 ml / dk, ardından aseptik koşullar altında 2-3 ml / dk hızında başlanmalıdır.
Belirteçler
K vitamini antagonistleri ile tedavinin neden olduğu eksiklik gibi protrombin kompleksinin pıhtılaşma faktörlerinin edinilmiş eksikliği olan hastalarda veya eksikliğin derhal düzeltilmesi gerektiğinde K vitamini antagonistleri ile doz aşımı durumunda ameliyat sırasında kanamanın tedavisi ve kanamanın önlenmesi. K vitaminine bağlı pıhtılaşma faktörleri II ve X'in konjenital eksikliklerinde ameliyat sırasında kanamanın tedavisi ve kanamanın önlenmesi, ilgili pıhtılaşma faktörünün saflaştırılmış bir preparatı mevcut olmadığında.
Kontrendikasyonlar
Etkin maddeye veya yardımcı maddelerden herhangi birine aşırı duyarlılık. Heparin veya heparinin neden olduğu trombositopeniye karşı bilinen alerji. Anti-IgA antikorlarının varlığı ile IgA eksikliği.
Önlemler
K vitaminine bağlı pıhtılaşma faktörlerinin edinilmiş eksikliği olan hastalarda (örneğin, K vitamini antagonistlerinin etkisi altında), ilaç yalnızca, büyük kanama veya acil ameliyat durumunda olduğu gibi, protrombin kompleksi seviyelerinin hızlı bir şekilde düzeltilmesi gerektiğinde kullanılmalıdır. Diğer durumlarda, K vitamini antagonistinin dozunun azaltılması ve / veya K vitamini verilmesi genellikle yeterlidir. K vitamini antagonistleri ile tedavi edilen hastalar, protrombin kompleksi konsantresinin infüzyonundan sonra şiddetlenebilen, birlikte var olan bir hiper pıhtılaşma durumuna sahip olabilir. Herhangi bir K vitaminine bağımlı faktörün doğuştan eksikliğinde, varsa spesifik pıhtılaşma faktörü preparatı kullanılmalıdır. Alerjik veya anafilaktik reaksiyon durumunda infüzyon derhal durdurulmalıdır. Şok durumunda, şok için standart tıbbi tedavi uygulanmalıdır. İnsan kanı veya plazma preparatlarının neden olduğu enfeksiyonu önlemeye yönelik standart yöntemler arasında donörlerin seçilmesi, belirli enfeksiyon belirteçleri için bireysel bağışların ve plazma havuzlarının test edilmesi ve virüsleri etkisiz hale getirmek / ortadan kaldırmak için etkili üretim yöntemlerinin kullanılması yer alır. Buna rağmen, insan kanı veya plazmasından hazırlanan tıbbi ürünler uygulandığında, enfektif ajanların bulaşma olasılığı tamamen ortadan kaldırılamaz. Bu aynı zamanda bilinmeyen veya ortaya çıkan virüsler ve diğer patojenler için de geçerlidir. Kullanılan yöntemlerin HIV, HBV ve HCV gibi zarflı virüslere karşı etkili olduğu kabul edilir ve HAV ve parvovirüs B19 gibi zarfsız virüslere karşı sınırlı değeri olabilir (hamile kadınlar ve immün yetmezliği veya aşırı eritropoezi olan hastalar için tehlikeli olabilir). İnsan plazma protrombin kompleksi preparatlarının düzenli / tekrarlanan uygulaması durumunda yeterli aşılar (hepatit A ve B'ye karşı) tavsiye edilir. Hastalar, yaygın intravasküler pıhtılaşma veya trombozun belirti ve semptomları açısından izlenmelidir - özellikle tekrarlanan dozlardan sonra insan protrombin kompleksi ile tedavi edilen hem konjenital hem de kazanılmış eksikliği olan hastalarda tromboz veya yaygın intravasküler pıhtılaşma riski vardır. Tromboembolik komplikasyon riski nedeniyle, iskemik kalp hastalığı, karaciğer hastalığı öyküsü olan hastalarda, ameliyat sırasında veya sonrasında, yeni doğanlarda veya tromboembolik komplikasyon riski olan hastalarda insan protrombin kompleksi uygulamasının ardından yakın izleme yapılmalıdır. yaygın intravasküler pıhtılaşma sendromu; bu vakaların her birinde, tedavinin potansiyel faydaları, bu komplikasyonların risklerinden daha ağır basmalıdır. Yenidoğanlarda K vitamini eksikliğine bağlı perinatal kanamanın tedavisinde ilacın kullanımına ilişkin veri bulunmamaktadır. Bu ilaç, flakon başına 75-125 mg sodyum içerir ve bu sodyum diyet kontrolündeki hastalarda dikkate alınmalıdır.
İstenmeyen aktivite
Yaygın: Derin ven trombozu Yaygın olmayan: anksiyete, tromboz, hipertansiyon, pulmoner emboli, bronkospazm, hemoptizi, epistaksis, enjeksiyon yerinde yanma hissi, yüksek D-dimer, yüksek kan trombini, anormal karaciğer fonksiyon testleri, cihazda tromboz. Pazarlama sonrası deneyim bildirilmiştir: anafilaktik şok, aşırı duyarlılık reaksiyonları, titreme, kalp durması, taşikardi, dolaşım bozukluğu, hipotansiyon, dispne, solunum yetmezliği, bulantı, ürtiker, döküntü, titreme. Bu ilaç heparin içerdiğinden, trombosit sayısında alerjik bir reaksiyonun neden olduğu 100.000 / µl'nin veya orijinal trombosit sayısının (tip II trombositopeni)% 50'sinin altına ani bir düşüş gözlemlemek nadiren mümkündür. Daha önce heparine aşırı duyarlı olmayan hastalarda, trombosit sayısındaki bu düşüş tedaviye başladıktan 6-14 gün sonra ortaya çıkabilir. Önceden heparin aşırı duyarlılığı olan hastalarda bu azalma saatler içinde ortaya çıkabilir. Böyle bir alerjik reaksiyon gösteren hastalarda preparat ile tedavi derhal kesilmelidir. Bu hastalar gelecekte heparin içeren preparatlarla tedavi edilmemelidir.
Gebelik ve emzirme
Gebelik ve emzirme döneminde insan protrombin kompleksinin kullanımının güvenliği belirlenmemiştir ve bu nedenle insan protrombin kompleksi yalnızca kesin olarak endike olduğunda kullanılmalıdır.
Yorumlar
Yüksek dozda insan protrombin kompleksi alan hastalarda heparine bağlı pıhtılaşma testleri yapılırken, uygulanan ilaçtaki eksipiyan heparin miktarı dikkate alınmalıdır.
Etkileşimler
İnsan protrombin kompleksi preparatları, K vitamini antagonistleri ile tedavinin etkisini nötralize eder, ancak diğer ilaçlarla etkileşimleri bilinmemektedir.
Preparat şu maddeyi içerir: Faktör II, Faktör IX, Faktör X, Faktör VII, Protein C, Protein S
Geri ödenen ilaç: HAYIR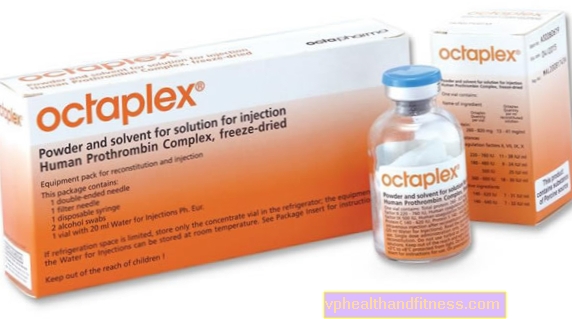



-to-badanie-rozpoznajce-choroby-mzgu-na-czym-polega-eeg.jpg)






---waciwoci-wartoci-odywcze-i-zastosowanie.jpg)