1 ml çözelti 1 mg galsülfaz içerir. Hazırlık sodyum içerir.
| İsim | Paket içeriği | Aktif madde | Fiyat% 100 | Son düzenleme |
| Naglazyme | Hazırlanacak son 5 ml'lik 1 şişe çözüm inf için. | Galsülfaz | 2019-04-05 |
Aksiyon
Sindirim sistemini ve metabolizma ürünlerini etkileyen bir ilaç. MPS VI, terminal glikozaminoglikan sülfat dermatan sülfat kalıntılarının hidrolizini katalize eden bir lizozomal hidrolaz olan 4-sülfataz-N-asetilgalaktozamin eksikliği ile karakterize heterojen ve çok sistemli bir bozukluktur. Azalmış veya enzim aktivitesi eksikliği, birçok hücre ve doku tipinde dermatan sülfat birikmesine yol açar. Terapinin gerekçesi, biriken substratı hidrolize etmek için yeterli enzimatik aktiviteyi eski haline getirmek ve daha fazla birikmesini önlemektir. Cmax 2357 (± 1560) ng / ml idi, eliminasyon fazında ortalama T0.5 24. haftada 22.8 (± 10.7) dakikaydı. Galsülfaz, peptit hidrolizine maruz kalır. Galsülfazın renal atılımı, ilacın vücuttan atılmasına çok az katkıda bulunur.
Dozaj
Hastalığın geri dönüşü olmayan klinik semptomlarının ortaya çıkmasından önce tedaviye mümkün olduğunca erken başlamak önemlidir. Tedavi, MPS VI veya diğer kalıtsal metabolik hastalıkları olan hastaların yönetiminde deneyimli bir hekimin gözetimi altında olmalıdır. Naglazyme, yaşamı tehdit eden acil durumların tedavisi için yaşam destek ekipmanına anında erişime sahip uygun bir klinik ortamda uygulanmalıdır. Önerilen galsülfaz dozu 1 mg / kg vücut ağırlığıdır. 4 saatin üzerinde intravenöz infüzyon olarak haftada bir verilir Özel hasta grupları. Yaşlılar: Preparatın güvenliği ve etkinliği belirlenmemiştir ve alternatif bir dozlama programı için herhangi bir öneri bulunmamaktadır. Böbrek ve karaciğer bozuklukları: Preparatın güvenliği ve etkinliği değerlendirilmemiştir ve bu hastalar için alternatif bir dozlama programı için herhangi bir öneri bulunmamaktadır. Çocuklar ve ergenler: Bu hasta grubunda preparatı uygularken dikkate alınması gereken özel kurallar yoktur. Uygulama şekli: İlk infüzyon hızı, toplam solüsyonun yaklaşık% 2,5'i 1 saat içinde uygulanacak ve kalan hacim (yaklaşık% 97,5) sonraki 3 saat içinde uygulanacak şekilde ayarlanabilir. Sıvı hacmi aşırı yüklenmesine duyarlı hastalarda ve 20 kg'ın altında ise 100 ml'lik infüzyon torbaları kullanmayı düşünün. Bu durumda, infüzyon hızı (ml / dak), toplam infüzyon süresi 4 saatten az olmayacak şekilde azaltılmalıdır.
Belirteçler
Mukopolisakkaridoz tip VI (MPS VI; N-asetilgalaktozamin 4-sülfataz eksikliği; Maroteaux-Lamy sendromu) tanısı doğrulanmış hastalarda uzun süreli enzim ikamesi. Tedavinin temel dayanağı, 5 yaşından küçük, şiddetli hastalığı olan genç hastaların tedavisidir, ancak 5 yaşından küçük hastalar merkezi faz 3 çalışmasına katılmamıştır. 1 yaşın altındaki hastalarda sınırlı veri mevcuttur.
Kontrendikasyonlar
Aktif maddeye veya yardımcı maddelerden herhangi birine akut veya yaşamı tehdit eden aşırı duyarlılık, eğer aşırı duyarlılık kontrol edilemiyorsa.
Önlemler
Kısıtlayıcı akciğer hastalığı olan hastaların yönetimi ve tedavisinde veya antihistaminik ve diğer yatıştırıcıların kullanımının dikkatlice izlenmesinde dikkatli olunmalıdır. Uyku sırasında pozitif hava yolu basıncı kullanımı ve klinik olarak uygun olduğunda trakeostomi olasılığı göz önünde bulundurulmalıdır. Akut ateşli hastalığı olan veya solunum problemleri olan hastalarda ilacın infüzyonunun ertelenmesi gerekebilir. İnfüzyon sırasında veya infüzyon gününün bitiminden önce meydana gelen herhangi bir advers reaksiyon anlamına geldiği anlaşılan infüzyonla ilişkili reaksiyonlar (IAR'ler) potansiyeli nedeniyle, hastaların antipiretiklerle kombinasyon halinde antihistaminiklerle önceden ilaçlanması önerilir. veya onlarsız, yaklaşık 30-60 dak. IAR semptomları riskini azaltmak için preparatın infüzyonuna başlamadan önce. Bir IAR'nin hafif ila orta dereceli semptomları için, antihistaminikler ve parasetamol ile tedaviyi değerlendirin ve / veya infüzyon hızını yanıt oranının yarısından daha aza indirin. IAR'lerin tek şiddetli semptomları durumunda, infüzyon semptomlar düzelene kadar durdurulmalı ve antihistaminler ve parasetamol ile tedavi düşünülmelidir. İnfüzyon, yanıt verdiği hızın% 50 -% 25'i oranında yeniden başlatılabilir. Tekrarlayan orta dereceli IAR semptomları veya tek şiddetli IAR semptomlarından sonra yeniden tedavi için, premedikasyon (antihistaminikler ve parasetamol ve / veya kortikosteroidlerle) ve infüzyon oranını önceki yanıtın oluştuğu oranın% 50 -% 25'ine düşürmeyi düşünün. Ciddi alerjik tip aşırı duyarlılık reaksiyonları meydana gelebilir, ortaya çıkarsa, preparatın derhal kesilmesi ve uygun tedavinin uygulanması önerilir. Acil bir durumla başa çıkmak için geçerli kurallara uyulmalıdır. İlacın infüzyonu sırasında alerjik reaksiyon yaşayan hastalar, özellikle dikkatle yeniden denenmelidir; Uygulama sırasında özel eğitimli tıbbi personel ve mevcut resüsitasyon ekipmanı (adrenalin dahil) mevcut olmalıdır. Kontrol edilemeyen akut veya potansiyel olarak yaşamı tehdit eden aşırı duyarlılık, yeniden dozlama için bir kontrendikasyondur. Preparat sodyum içerir - sınırlı sodyum içeriği olan diyet uygulayan hastalarda dikkatli olunmalıdır. Omurilik basısı, yine servikal bölgede, sonradan miyelopati ile birlikte, MPS VI'nın neden olabileceği bilinen ve ciddi bir komplikasyondur - hastalar, omurilik sıkışmasının belirti ve semptomları (sırt ağrısı, basınç noktasının altında felç, inkontinans) açısından izlenmelidir. idrar ve dışkı) ve gerekirse uygun bakımı alın.
İstenmeyen aktivite
Çok yaygın: farenjit, gastroenterit, arefleksi, baş ağrısı, konjunktivit, korneal opasite, kulak ağrısı, işitme bozukluğu, hipertansiyon, dispne, burun tıkanıklığı, karın ağrısı, göbek fıtığı, kusma, bulantı, yüz ödemi, döküntü , kurdeşen, kaşıntı, ağrı, göğüs ağrısı, titreme, halsizlik, ateş, eklem ağrısı. Yaygın: konvülsiyonlar, hipotansiyon, apne, öksürük, solunum yetmezliği, astım, bronkospazmlar, eritem Bilinmiyor: anafilaktik reaksiyon, şok, parestezi, bradikardi, taşikardi, siyanoz, solukluk, laringeal ödem, hipoksi, hızlı nefes alma.
Gebelik ve emzirme
İlaç, açıkça gerekmedikçe hamilelik sırasında kullanılmamalıdır. Hazırlık ile tedavi sırasında emzirmeye son verilmelidir. İlacı 3 mg / kg / gün'e kadar dozlarda alan sıçanlarda ve tavşanlarda yürütülen üreme çalışmaları, doğurganlıkta bozulma veya ilacın neden olduğu fetüse zararlı etkilere dair hiçbir kanıt göstermemiştir.
Hazırlık şu maddeyi içerir: Galsulfase
Geri ödenen ilaç: HAYIR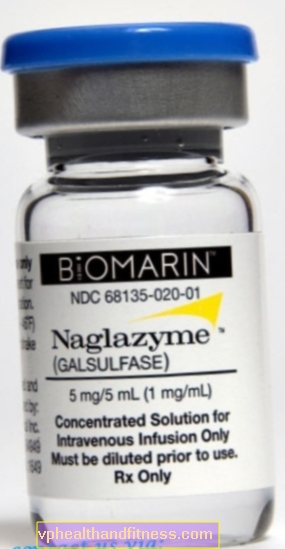














-pod-kontrol.jpg)







---przyczyny-objawy-i-leczenie.jpg)