1 ml çözelti, 100 mg insan normal immünoglobülini (en az% 95 IgG dahil) içerir. IgG alt sınıflarının dağılımı: IgG1 - yaklaşık% 60, IgG2 - yaklaşık% 32, IgG3 - yaklaşık% 7, IgG4 - yaklaşık% 1. Maksimum IgA içeriği 0,4 mg'dan fazla değildir. Çözeltinin pH'ı 4.5 - 5.0'dır; ozmolalitesi ≥ 240 mOsmol / kg'dır. Bu ilaç, her ml çözelti için 0.03 mmol (0.69 mg) sodyumdan fazlasını içermez. Hazırlık maltoz içerir.
| İsim | Paket içeriği | Aktif madde | Fiyat% 100 | Son düzenleme |
| Octagam% 10 | ayakkabı. 200 ml çöz. inf için. | İmmünoglobulin normal insan | 2019-04-05 |
Aksiyon
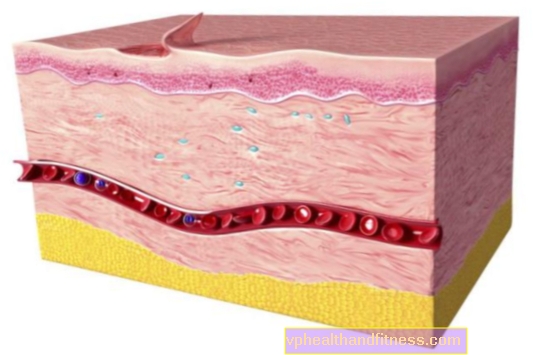
İnsan normal immünoglobülini, enfeksiyöz ajanlara karşı geniş bir antikor spektrumu ile temel olarak işlevsel olarak değişmemiş immünoglobulin G'den (IgG) oluşur. Doğal insan plazmasındakiyle yakından orantılı bir immünoglobulin G alt sınıf dağılımına sahiptir. Yeterince yüksek insan normal immünoglobulin dozları, anormal derecede düşük immünoglobulin G seviyelerini normal aralığa geri getirebilir. Replasman tedavisi dışındaki endikasyonlar üzerinde uygulanan ilacın etki mekanizması tam olarak aydınlatılmamıştır, ancak immünomodülatör etkileri içerdiği bilinmektedir. İnsan normal immünoglobulini, intravenöz uygulamadan sonra alıcının dolaşımında hemen ve tamamen biyolojik olarak bulunur. Plazma ve hücre dışı sıvı arasında nispeten hızlı bir şekilde dağıtılır; 3-5 gün sonra, damar içi ve damar dışı bölmeler arasında bir denge durumu oluşturulur. Preparatın uygulanmasından sonra bağışıklığı zayıflamış hastalarda IgG için yarı ömür 26 ila 41 gün arasında değişir. Yarı ömür, özellikle birincil immün yetmezlik vakalarında hastadan hastaya değişebilir. İmmünoglobulin G (IgG) ve kompleksleri, retiküloendotelyal sistem hücrelerinde bozulur.
Dozaj
Damardan. Yetişkinler ve çocuklar (0-18 yaş). İmmün yetmezlik tedavisinde deneyimli bir doktor gözetiminde yerine koyma tedavisi başlatılmalı ve izlenmelidir. Doz ve dozaj rejimi endikasyona bağlıdır. Replasman tedavisinde, farmakokinetik ve klinik yanıta bağlı olarak dozun hasta için kişiselleştirilmesi gerekebilir. Aşağıdaki dozlama programları kılavuz niteliğindedir. Birincil immün yetmezliklerde yerine koyma tedavisi. Dozlama rejimi, en az 5-6 g / l IgG çukur seviyelerine (bir sonraki infüzyondan önce ölçülmüştür) ulaşmalıdır. Tedaviye başladıktan sonra antikor eksikliğinin düzeltilmesi 3-6 ay sürer. Önerilen başlangıç dozu 0,4-0,8 g / kg'dır. bir kez uygulandıktan sonra 0,2 g / kg vücut ağırlığı kullanılır. Her 3-4 haftada bir 5-6 g / l IgG düzeylerine ulaşmak için ayda 0.2-0.8 g / kg canlı ağırlık dozu gereklidir. Kararlı duruma ulaştıktan sonra dozlar arasındaki aralık 3-4 haftadır.Çukur konsantrasyonlarının belirlenmesi ve değerlendirilmesi enfeksiyon insidansı ile ilişkili olarak yapılmalıdır. Enfeksiyon oranını düşürmek için dozu artırmak ve daha yüksek çukur seviyeleri hedeflemek gerekebilir. Antibiyotik profilaktik tedavisinin tatmin edici sonuçlar vermediği kronik lenfositik lösemi hastalarında hipogamaglobulinemi ve tekrarlayan bakteriyel enfeksiyonlar; pnömokok aşılamasına yanıt vermeyen multipl miyelomun plato fazındaki hastalarda hipogamaglobulinemi ve tekrarlayan bakteriyel enfeksiyonlar; Tekrarlayan bakteriyel enfeksiyonlarla birlikte doğuştan AIDS: önerilen doz 0.2-0.4 g / kg'dır. Her 3-4 haftada bir Allojenik hematopoetik kök hücre naklinden sonra hastalarda hipogamaglobulinemi: Önerilen doz her 3-4 haftada bir 0.2-0.4 g / kg'dır.Çukur seviyeleri 5 g / l'nin üzerinde tutulmalıdır. Birincil immün trombositopeni. İki alternatif tedavi programı vardır: 1. tedavi gününde 0.8-1 g / kg; bu doz 3 günde bir kez veya 0,4 g / kg / 24 saatte 2-5 gün tekrarlanabilir. Hastalık tekrarlarsa tedavi tekrar edilebilir. Guillain Barre sendromu: 0,4 g / kg canlı ağırlık 5 gün boyunca günlük. Kawasaki hastalığı: 1.6-2 g / kg 2-5 gün bölünmüş dozlar halinde veya 2 g / kg vücut ağırlığı tek doz halinde. Hastalar asetilsalisilik asit ile tedavi edilmelidir. Verme yolu. 30 dakika boyunca 0.01 ml / kg canlı ağırlık / dakika başlangıç hızında intravenöz olarak infüzyon olarak uygulayın. İyi tolere edilirse, uygulama hızı kademeli olarak maksimum 0.12 ml / kg / dakikaya yükseltilebilir.
Belirteçler
Yetişkinlerde, çocuklarda ve ergenlerde (0-18 yaş) yerine koyma tedavisi. Bozulmuş antikor üretimi olan birincil immün yetmezlik sendromları. Antibiyotik profilaktik tedavisinin tatmin edici sonuçlar vermediği kronik lenfositik lösemili hastalarda hipogamaglobulinemi ve tekrarlayan bakteriyel enfeksiyonlar. Pnömokok immünizasyonuna yanıt vermeyen multipl miyelomun plato fazındaki hastalarda hipogamaglobulinemi ve tekrarlayan bakteriyel enfeksiyonlar. Allojenik hematopoetik kök hücre nakli (HSCT) sonrası hastalarda hipogamaglobulinemi. Tekrarlayan bakteriyel enfeksiyonlu konjenital AIDS. Yetişkinlerde, çocuklarda ve ergenlerde (0-18 yaş) immünomodülasyon. Kanama riski yüksek olan hastalarda veya ameliyattan önce kandaki trombosit sayısını artırmak için birincil immün trombositopeni (ITP). Guillain Barré ekibi. Kawasaki hastalığı.
Kontrendikasyonlar
Etkin maddeye veya yardımcı maddelerden herhangi birine aşırı duyarlılık. Özellikle IgA'ya karşı antikorları olan hastalarda insan immünoglobulinlerine aşırı duyarlılık.
Önlemler
Dozlama talimatlarına uymak ve öngörülen infüzyon hızına kesinlikle uymak önemlidir. İnfüzyon sırasında hastalar yan etkiler açısından dikkatle izlenmelidir. Bazı yan etkiler, yüksek infüzyon hızında veya ilk kez insan normal immünoglobulini alan hastalarda veya nadir durumlarda, normal insan immünoglobulininden farklı bir preparata geçerken veya önceki infüzyondan daha uzun bir aradan sonra daha yaygın olabilir. Hastaların aşağıdakilerin sağlanmasıyla olası komplikasyonlardan kaçınılabilir: başlangıçta preparatı yavaş bir hızda (0.01 ila 0.02 ml / kg canlı ağırlık / dakika) uygulayarak insan normal immünoglobulinine aşırı duyarlı olmamak; İnfüzyon süresi boyunca herhangi bir semptom için dikkatle izlenir.Özellikle, daha önce normal insan immünoglobulini ile tedavi almamış hastalar, daha önce alternatif bir IVIg preparatı almış hastalar veya önceki infüzyonun üzerinden uzun bir süre geçmişse, ilk infüzyon sırasında ve tamamlandıktan sonraki ilk saat içinde izlenmelidir. Diğer tüm hastalar en az 20 dakika takip edilmelidir. preparatın uygulanmasından sonra. Olumsuz bir reaksiyon meydana gelirse, infüzyon hızı azaltılmalı veya kesilmelidir. Şok durumunda uygun tıbbi tedavi başlatılmalıdır. Tüm hastalarda intravenöz Ig uygulaması şunları gerektirir: intravenöz Ig infüzyonuna başlamadan önce hastanın yeterli hidrasyonu, diürezin izlenmesi, serum kreatininin izlenmesi, birlikte döngü diüretiklerinin kullanımından kaçınılması. Gerçek aşırı duyarlılık reaksiyonları nadirdir: IgA'ya karşı antikorları olan hastalarda ortaya çıkabilir. IgA eksikliğinin tek anormallik olduğu selektif IgA eksikliği olan hastalarda ilaç endike değildir. Nadir durumlarda, insan immünoglobülini uygulaması, daha önce insan immünoglobulin tedavisini tolere etmiş hastalarda bile anafilaktik reaksiyon ile kan basıncında düşüşe neden olabilir. IVIg infüzyonları aşırı kilolu hastalarda ve yaşlılık, hipertansiyon, diyabet, vasküler hastalık veya trombotik olay öyküsü gibi trombotik olaylar için mevcut risk faktörleri olan hastalarda, edinilmiş veya doğuştan trombotik bozukluklar, uzun süreli immobilizasyon, şiddetli hastalarda dikkatle uygulanmalıdır. hipovolemi, seyrinde kan viskozitesinin arttığı hastalıklar. IVIg preparatları ile tedavi edilen hastalarda akut böbrek yetmezliği vakaları bildirilmiştir, çoğu vakada önceden var olan böbrek yetmezliği, diabetes mellitus, hipovolemi, aşırı kilo, eşlik eden nefrotoksik ilaçlar, 65 yaş üstü gibi risk faktörleri tanımlanmıştır. Böbrek fonksiyon bozukluğu vakalarında IVIg tedavisinin kesilmesi düşünülmelidir. Disfonksiyon ve akut böbrek yetmezliği raporları, birçok onaylanmış IVIg ürününün (yardımcı maddeler olarak sakaroz, glikoz, maltoz içeren) kullanımıyla ilişkilendirilmiştir, ancak stabilizatör olarak sükroz içeren preparatlar, toplam vaka sayısına orantısız bir şekilde katkıda bulunmuştur; Risk altındaki hastalarda, bu yardımcı maddeleri içermeyen IVIg ürünlerinin kullanımı düşünülebilir. Yüksek akut böbrek yetmezliği veya tromboembolik advers reaksiyon riski taşıyan hastalarda, IVIg preparatları minimum infüzyon hızında ve uygulanabilir dozda uygulanmalıdır. IVIg tedavisi ile ilişkili olarak aseptik menenjit sendromu (AMS) bildirilmiştir; IVIg tedavisinin kesilmesi, AMS'nin sekelsiz günler içinde remisyonuyla sonuçlandı. IVIg alıcıları, hemolizin klinik belirti ve semptomları açısından izlenmelidir. İnsan kanı veya plazmasına dayalı preparatlarla bulaşan enfeksiyonların önlenmesine yönelik standart önlemlere rağmen, bu tür preparatlar uygulandığında, enfektif ajanların bulaşma olasılığı tamamen ortadan kaldırılamaz. Bu aynı zamanda bilinmeyen veya ortaya çıkan virüsler veya diğer patojenler için de geçerlidir. Kullanılan yöntemlerin HIV, HBV ve HCV gibi zarflı virüslerin bulaşmasını önlemede etkili olduğu kabul edilir, ancak HAV ve parvovirüs B19 gibi zarfsız virüslere karşı sınırlı kullanılabilir. Klinik deneyimler, immünoglobulin preparatları ile hepatit A virüsünün veya parvovirüs B19'un bulaşmadığını göstermektedir. Bu preparatlarda bulunan antikorların varlığının da bu preparatların güvenliğine katkıda bulunduğu düşünülmektedir. IVIG ile tedavi edilen hastalarda kardiyojenik olmayan pulmoner ödem (akut post-transfüzyon akciğer hasarı - ciddi solunum sıkıntısı, pulmoner ödem, hipoksemi, normal sol ventrikül fonksiyonu ve ateş, transfüzyondan 1-6 saat sonra) bildirilmiştir, Octagam uygulanırken dikkatli olunmalıdır. bu preparatın uygulanmasından sonra şimdiye kadar böyle bir durum gözlemlenmemiştir. IVIG uygulaması sırasında, uygulanan preparatın hacmi ve uygulanan diğer infüzyonlar akut hipervolemiye ve akut pulmoner ödem oluşturduğunda kardiyovasküler (hacim) aşırı yüklenme meydana gelebilir. Bu ilaç, her ml çözelti için 0.03 mmol (0.69 mg) sodyumdan fazlasını içermez. Bu, kontrollü sodyum diyetindeki hastalarda dikkate alınmalıdır.
İstenmeyen aktivite
Yaygın: aşırı duyarlılık, baş ağrısı, bulantı, yüksek ateş, yorgunluk, enjeksiyon bölgesi reaksiyonları Yaygın olmayan: egzama, sırt ağrısı, titreme, göğüs ağrısı. Çok seyrek: lökopeni, hemolitik anemi, anafilaktik şok, anafilaktik reaksiyon, anafilaktoid reaksiyon, anjiyoödem, yüz ödemi, konfüzyon durumu, huzursuzluk, anksiyete, beyin enfarktüsü, aseptik menenjit, bilinç kaybı, konuşma bozukluğu, migren, baş dönmesi, hipoestezi, parestezi, fotofobi, titreme, görme bozukluğu, miyokard enfarktüsü, anjina pektoris, bradikardi, taşikardi, çarpıntı, siyanoz, tromboz, dolaşım çökmesi, periferik dolaşım yetmezliği, flebit, hipotansiyon, hipertansiyon, solukluk, solunum yetmezliği, , pulmoner ödem, bronkospazm, hipoksi, dispne, öksürük, kusma, ishal, karın ağrısı, deride soyulma, ürtiker, döküntü, eritemli döküntü, dermatit, kaşıntı, alopesi, eritem artralji, kas ağrısı, ekstremite ağrısı, boyun ağrısı , kas spazmları, kas güçsüzlüğü, kas-iskelet sertliği, akut böbrek yetmezliği, böbrek ağrısı k, ödem, grip benzeri semptomlar, sıcak basması, kızarıklık, üşüme, sıcak hissetme, terleme, halsizlik, göğüste rahatsızlık, asteni, uyuşukluk, yanma hissi, karaciğer enzimlerinde artış, yanlış pozitif kan şekeri testi.
Gebelik ve emzirme
Gebelik. Hamile kadınlarda preparatın güvenliği kontrollü klinik çalışmalarda belirlenmemiştir. Hazırlık hamile kadınlara ve emziren kadınlara özel bir dikkatle uygulanmalıdır. IVIg preparatları, üçüncü trimesterde artan plasentayı geçer. İmmünoglobulin kullanımıyla ilgili klinik deneyim, bunların hamilelik, fetüsün veya yenidoğanın gelişimi üzerinde hiçbir zararlı etkisinin olmadığını göstermektedir. Emzirme. İmmünoglobulinler anne sütüne geçer ve yenidoğanın mukozaya nüfuz eden patojenlerden korunmasına yardımcı olabilir. Doğurganlık. İmmünoglobulin kullanımıyla ilgili klinik deneyim, doğurganlık üzerinde hiçbir zararlı etkinin beklenmediğini göstermektedir.
Yorumlar
Bazı yan etkiler, araç veya makine kullanma yeteneğini bozabilir. Tedavi sırasında yan etkiler yaşayan hastalar, araç veya makine kullanmadan önce bunların geçmesini beklemelidir. İmmünoglobulin uygulamasının ardından, hastanın kanında pasif olarak aktarılan çeşitli antikorların seviyesinde geçici bir artış olabilir ve bu da serolojik testlerde yanlış pozitif sonuçlara yol açabilir. A, B, D gibi eritrosit antijenlerine karşı pasif olarak transfer edilen antikorlar, serolojik testlerin sonuçlarına müdahale edebilir, örneğin direkt antiglobulin testi (Coombs testi). IVIG preparatları ile tedavi edilen hastalarda, kırmızı kan hücresi sedimantasyon hızı (ESR) yanlış bir şekilde yükselebilir (inflamatuvar olmayan artış). Hazırlık maltoz içerir, bu nedenle glikoz konsantrasyonunun belirlenmesi, glikoza özgü yöntemler kullanılarak yapılmalıdır.
Etkileşimler
Preparatın içerdiği immünoglobulinler 6 haftadan 3 aya kadar canlı, zayıflatılmış kızamık, kabakulak, kızamıkçık veya suçiçeği aşılarının etkinliğini azaltabilir (uygulama ile aşılama arasında 3 aylık bir süre korunmalıdır; kızamık aşısı durumunda halsizlik) İmmün yanıt bir yıla kadar devam edebilir, bu nedenle kızamık antikorlarının aşılamadan önce ölçülmesi önerilir). Preparat diğer ilaçlarla karıştırılmamalıdır.
Hazırlık şu maddeyi içerir: İmmünoglobulin normal insan
Geri ödenen ilaç: HAYIR



-to-badanie-rozpoznajce-choroby-mzgu-na-czym-polega-eeg.jpg)






---waciwoci-wartoci-odywcze-i-zastosowanie.jpg)