1 flakon nominal olarak 250 IU, 500 IU içerir veya 1000 IU insan pıhtılaşma faktörü VIII. Bu ilaç sodyum (1 mmol (23 mg) / flakon 250 IU'dan az, 1,75 mmol (40 mg) / 500 IU flakon ve 1,75 mmol (40 mg) / flakon 1000 IU'ya kadar) içerir.
| İsim | Paket içeriği | Aktif madde | Fiyat% 100 | Son düzenleme |
| Oktanat | 1 şişe 1000 IU + çözündürme, toz haline getirme ve çözündürme hazırlanacak çözüm şok için ve / veya inf. | Faktör VIII | 2019-04-05 |
Aksiyon
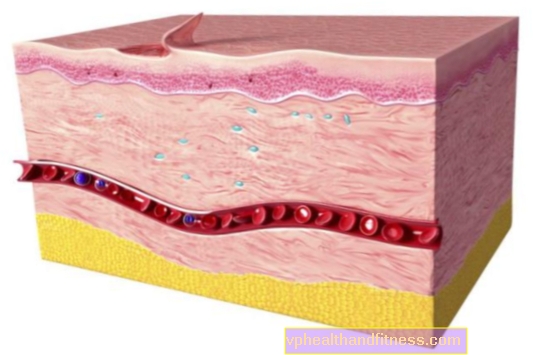
Antihaemorajik ilaç, kan pıhtılaşma faktörü VIII. Koagülasyon faktörü VIII, farklı fizyolojik fonksiyonlara sahip olan von Willebrand faktörü (FVIII ve vWF) ile iki moleküllü bir kompleks olarak bulunur. Hemofili hastalarına verildiğinde, faktör VIII hastanın kan dolaşımındaki von Willebrand faktörüne bağlanır. Aktif faktör VIII, faktör X'in aktif faktör X'e dönüşümünü hızlandıran, aktif faktör IX'un bir kofaktörü olarak hareket eder. Aktif faktör X, protrombini trombine dönüştürür. Trombin daha sonra fibrinojeni fibrine dönüştürerek bir pıhtı oluşmasına izin verir. Preparatın enjekte edilmesinden sonra, faktör VIII'in yaklaşık 2/3 ila 3 / 4'ü dolaşımda kalır. Plazmada elde edilen faktör VIII aktivite seviyesi, tahmin edilen faktör VIII aktivitesinin% 80 ila% 120'si arasında olmalıdır. Plazmadaki Faktör VIII aktivitesi, iki fazlı üstel dağılımda azalır. İlk aşamada, intravasküler ve diğer bölmeler (vücut sıvıları) arasındaki dağılım, 3 ila 6 saatlik bir plazma eliminasyon yarılanma ömrüne sahiptir. .
Dozaj
İntravenöz olarak 2-3 ml / dk'dan fazla uygulamayın. İkame terapisinin dozajı ve süresi faktör VIII eksikliğinin ciddiyetine, kanamanın yerine ve boyutuna ve hastanın klinik durumuna bağlıdır. Uygulanan faktör VIII birimlerinin sayısı, DSÖ onaylı faktör VIII preparatları için mevcut standart olan Uluslararası Birimler (IU) cinsinden ifade edilir. Plazmadaki Faktör VIII aktivitesi, yüzde (normal insan plazmasına göre) veya IU cinsinden ifade edilir. plazmada faktör VIII için uluslararası standartlara uygun 1 IU Faktör VIII aktivitesi, 1 ml normal insan plazmasındaki faktör VIII miktarına eşdeğerdir. Gerekli faktör VIII dozunun hesaplanması, 1 IU'nun sahip olduğu ampirik verilere dayanmaktadır. faktör VIII / kg plazma faktör VIII aktivitesini normal aktivitenin% 1.5-2'si kadar arttırır. Gerekli doz, aşağıdaki formül kullanılarak belirlenir: gerekli birim sayısı = ay. (kg) x gerekli faktör VIII artışı (%) (IU / dL) x 0.5. Uygulama dozu ve sıklığı ayrı ayrı belirlenmelidir. Eklemlerde, kaslarda veya ağızda erken kanama: Gerekli faktör VIII seviyesi normalin% 20-40'ı kadardır, kanamanın neden olduğu ağrı geçene veya yara iyileşene kadar her 12-24 saatte bir, en az 1 gün infüzyon tekrarlanmalıdır. Eklemlerde, kaslarda veya hematomda daha kapsamlı kanama: Normalin% 30-60'ı, ağrı giderilinceye ve işlev geri dönene kadar her 12-24 saatte bir 3-4 gün veya daha uzun süreyle tekrarlayın. Hayatı tehdit eden kanama: Normalin% 60-100'ü, tehdit çözülene kadar her 8-24 saatte bir infüzyonu tekrarlayın. Diş çekimi dahil küçük cerrahi: yara iyileşene kadar her 24 saatte bir, en az 1 gün normun% 30-60'ı. Büyük cerrahi: Normalin% 80-100'ü (ameliyattan önce ve sonra), yara yeterince iyileşene kadar her 8-24 saatte bir infüzyonları tekrarlayın, ardından 30 ° C'de faktör VIII aktivitesini sürdürmek için art arda en az 7 gün boyunca tedaviye devam edin. -% 60. Sürekli infüzyon: Tahmini klirens ameliyattan önce hesaplanmalıdır. İlk infüzyon hızı şu şekilde hesaplanabilir: klerens x istenen kararlı durum konsantrasyonu = infüzyon hızı (IU / kg / sa). İlk 24 saatlik sürekli infüzyondan sonra, klerens, ölçülen konsantrasyon ve bilinen infüzyon hızıyla katı hal formülü kullanılarak her gün yeniden hesaplanmalıdır. Dozu hesaplamak ve infüzyon sıklığını belirlemek için plazma faktör VIII seviyelerinin düzenli olarak belirlenmesi gereklidir. Şiddetli hemofili A hastalarında uzun süreli kanama profilaksisi için, faktör VIII dozu 20-40 IU uygulanmalıdır. faktör VIII / kg 2-3 günlük aralıklarla.
Belirteçler
Hemofili A (konjenital faktör VIII eksikliği) olan hastalarda kanamanın tedavisi ve profilaksisi. İlaç, farmakolojik olarak etkili miktarda von Willebrand faktörü içermez ve bu nedenle von Willebrand hastalığının tedavisinde kullanılamaz.
Kontrendikasyonlar
Etkin maddeye veya bileşenlerden herhangi birine aşırı duyarlılık.
Önlemler
Aşırı duyarlılık semptomları ortaya çıkarsa, preparatı derhal kullanmayı bırakın. İnsan kanı veya plazma preparatlarının neden olduğu enfeksiyonu önlemeye yönelik standart yöntemler arasında donörlerin seçilmesi, belirli enfeksiyon belirteçleri için bireysel bağışların ve plazma havuzlarının test edilmesi ve virüsleri etkisiz hale getirmek / ortadan kaldırmak için etkili üretim yöntemlerinin kullanılması yer alır. Buna rağmen, insan kanı veya plazmasından hazırlanan tıbbi ürünler uygulandığında, enfektif ajanların bulaşma olasılığı tamamen ortadan kaldırılamaz. Bu aynı zamanda bilinmeyen veya ortaya çıkan virüsler ve diğer patojenler için de geçerlidir. Kullanılan yöntemlerin HIV, HBV ve HCV gibi zarflı virüslere karşı etkili olduğu kabul edilir ve HAV ve parvovirüs B19 gibi zarfsız virüslere karşı sınırlı değeri olabilir (hamile kadınlar ve immün yetmezliği veya aşırı eritropoezi olan hastalar için tehlikeli olabilir). İnsan pıhtılaşma faktörü VIII ile düzenli veya tekrarlanan tedavi gören hastalarda yeterli aşılar (hepatit A ve B'ye karşı) endikedir. Faktör VIII nötralize edici antikorların (inhibitörler) geliştirilmesi, hemofili A hastalarını tedavi ederken bilinen bir komplikasyondur - hastalar, uygun klinik gözlemler ve laboratuar testleri ile inhibe edici antikorların gelişimi açısından izlenmelidir. Literatürde, faktör VIII inhibitörlerinin oluşumu ile alerjik reaksiyonlar arasında bir ilişki olduğunu gösteren raporlar bulunmaktadır. Alerjik reaksiyon yaşayan hastalar, faktör VIII ile indüklenen anafilaksi riskinin artması nedeniyle inhibitör için test edilmelidir. Alerjik reaksiyon riski nedeniyle, ilk faktör VIII uygulaması, tedaviyi uygulayan hekimin takdirine bağlı olarak, alerjik reaksiyon durumunda yeterli tıbbi yardımın sağlanabileceği bir yerde tıbbi gözetim altında yapılmalıdır. İlaç sodyum içerir - 1 şişe 250 IU 1 mmol'den (23 mg) daha az sodyum içerir, yani bu doz temelde 'sodyum içermez' ve 1 şişe 500 IU'dur. veya 1000 IU Sodyum kısıtlı diyet uygulayan hastalarda dikkate alınması gereken 1,75 mmol (40 mg) sodyum içerir.
İstenmeyen aktivite
Nadir: aşırı duyarlılık reaksiyonları, ateş, kanda bulunan anti-faktör VIII antikorları. Çok seyrek: anafilaktik şok.
Gebelik ve emzirme
Kadınlarda hemofili A'nın nadir görülmesi nedeniyle, gebelik ve emzirme sırasında faktör VIII kullanımına ilişkin deneyim mevcut değildir. Bu nedenle, gebelik ve emzirme döneminde faktör VIII yalnızca kesin olarak endike olduğunda verilmelidir.
Etkileşimler
İnsan pıhtılaşma faktörü VIII preparatlarının diğer ilaçlarla bilinen hiçbir etkileşimi yoktur.
Preparat şu maddeyi içerir: Faktör VIII
Geri ödenen ilaç: HAYIR




-to-badanie-rozpoznajce-choroby-mzgu-na-czym-polega-eeg.jpg)






---waciwoci-wartoci-odywcze-i-zastosowanie.jpg)